稀有气体化合物
目录
稀有气体化合物
稀有气体化合物,周期表位于最右边的18族的元素,即,对于包含稀有气体元素的化合物的通用术语。
人们认为稀有气体元素不能与其他元素形成化合物。这是因为稀有气体元素的最外层壳被电子填充或最外层电子的数量为8,这在化学上非常稳定并且反应性低。
在氖气和较重的稀有气体元素中,外壳的s和p壳已充满电子。为了与其他元素形成化合物,必须从该状态获取电子。由于向稀有气体元素中添加了高电离能,或者必须将接近于零的电子亲和力用作驱动力,因此没有反应活性。
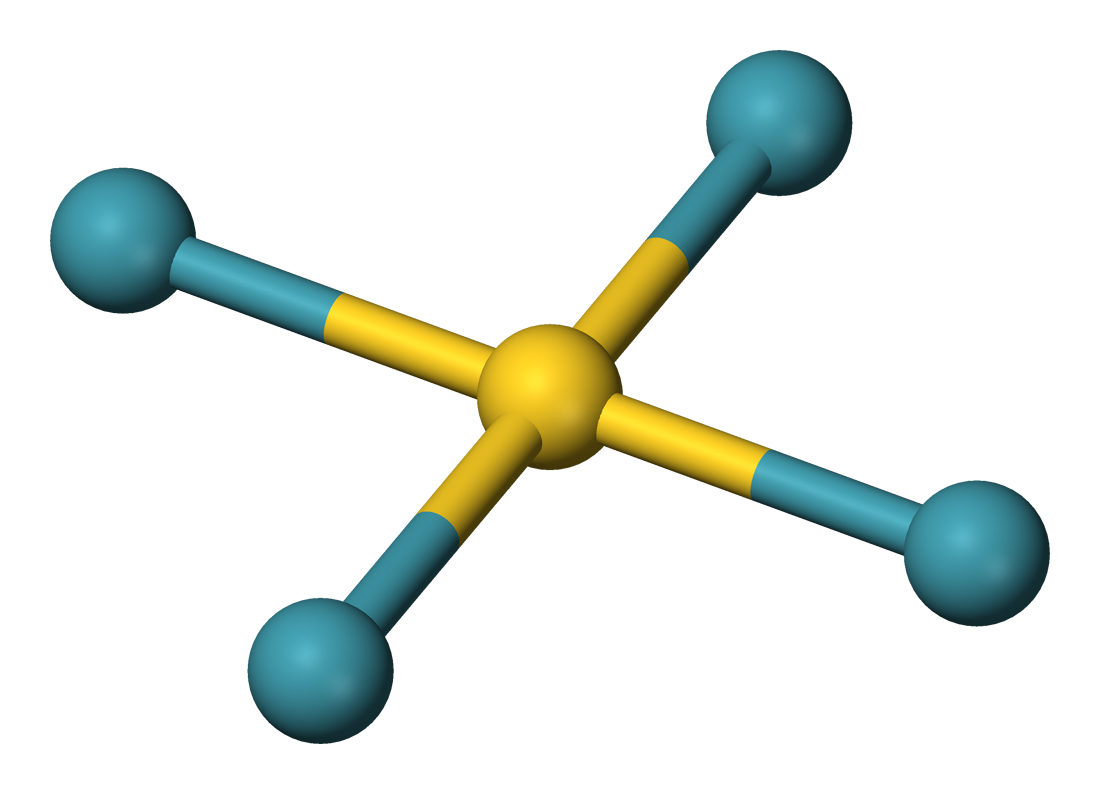
但是在1933年,莱纳斯·鲍林(Linus Pauling)预测,重的稀有气体会与氟和氧形成化合物。特别是他六氟化氪(KrF受6)和六氟化氙(XeF的6)预期是本,氟化氙一起8可能存在的为不稳定化合物的猜测,氙酸从过氙酸的建议,这将是盐可以使进行了。尽管这些预测中的许多是正确的,但XeF 8被认为是热力学和动力学不稳定的,直到2009年才合成任何示例。
重的惰性气体元素比轻的气体具有更多的电子壳。因此,原子外部的电子受到内部电子的较强屏蔽作用。另外,最外层电子的主量子数增加,轨道移离原子核。这些削弱了最外层电子与核之间的吸引力,甚至容易使稀有气体元素离子化。另外,这是普遍趋势,不限于稀有气体,而是“元素周期表中的元素具有相同组中最外层电子的最弱结合”。结果,电离能降低到重惰性气体元素可以与具有非常高电负性的元素(例如氟或氧)形成稳定化合物的程度。
稀有气体化合物用法
稀有气体化合物的使用通常作为稀有气体的氧化剂或通过使其更致密来存储。氙酸是一种有用的氧化剂,不含杂质,因为它在反应后仅以气体形式释放氙。xxx的臭氧仅是那些相当于。过烯酸是一种更强大的氧化剂,氟化氙是优良的氟化剂。
放射性同位素,例如k和氙,很难存储和处置,但是当用作化合物时,它们比气态更容易处理。
氙的短寿命准分子 Xe 2 *和稀有气体卤化物(例如XeCl 2)用于准分子激光器。