FFC剑桥法
目录
FFC剑桥法
FFC 剑桥法是一种通过在熔融钙盐中电解从氧化钛生产钛 (Ti) 的电化学方法。
历史
1904 年的德国专利描述了一种电化学生产钛的工艺。 在熔融的 CaCl2 溶液中,二氧化钛 (TiO2) 已被电解还原为金属。
FFC 剑桥法由 George Chen、Derek Fray 和 Thomas Farthing 于 1996 年至 1997 年间在剑桥大学开发。 (名称 FFC 源自发明人姓氏的首字母)。
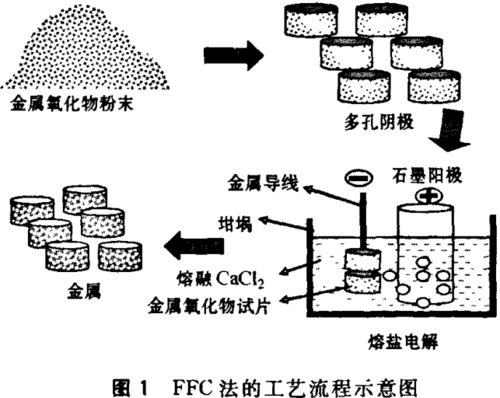
过程
该过程通常发生在 900 到 1100 °C 之间,阳极(通常是碳)和阴极(氧化物被还原)在熔融的 CaCl2 溶液中。 根据氧化物的性质,它会以相对于阳极的特定电位存在,这取决于 CaCl2 中存在的 CaO 的量。
阴极反应机理
电钙热还原机制可由以下反应序列表示,其中 M 表示要还原的金属(通常为钛)。
(1) MOx+ x Ca → M + x CaO
当这个反应单独发生时,它被称为钙热还原(或更一般地,金属热还原的一个例子)。 例如,如果阴极主要由 TiO2 制成,则钙热还原将显示为:
TiO + Ca → Ti + CaO
虽然阴极反应可以写成如上,但实际上它是逐渐从氧化物中去除氧气。 例如,已经表明 TiO2 不会简单地还原为 Ti。 事实上,它通过低级氧化物(Ti3O5、Ti2O3、TiO 等)还原为 Ti。
然后电解产生的氧化钙:
(2a) x CaO → x Ca2+ + x O2− (2b) x Ca2+ + 2x e− → x Ca
和
(2c) x O2− → x/2 O2 + 2x e−
反应 (2b) 描述了在阴极从盐中的 Ca2+ 离子生成 Ca 金属。 然后 Ca 将继续还原阴极。
反应 (1) 和 (2) 的最终结果只是将氧化物还原为金属和氧气:
(3) MOx→ M + x/2 O2
阳极反应机理
使用熔融 CaCl2 很重要,因为这种熔融盐可以溶解 O2- 离子并将其输送到阳极以进行放电。 阳极反应取决于阳极材料。 根据系统的不同,可以在碳阳极产生 CO 或 CO2 或混合物:
然而,如果使用惰性阳极,例如高密度 SnO2,O2- 离子的放电会导致氧气的释放。 然而,惰性阳极的使用具有缺点。 首先,当 CaO 浓度较低时,阳极处的 Cl2 析出变得更加有利。 此外,与碳阳极相比,需要更多的能量才能在阴极实现相同的还原相。 惰性阳极存在稳定性问题。