碳-氧键
目录
碳-氧键
碳-氧键是碳原子和氧原子之间的极性共价键。 碳-氧键存在于许多无机化合物中,如碳氧化物和卤氧化物、碳酸盐和金属羰基化合物,以及有机化合物,如醇、醚、羰基化合物和草酸盐。 氧有 6 个自己的价电子,并倾向于通过与其他原子共享电子形成共价键、接受电子形成阴离子或两者的组合,用 8 个电子填充其外壳。 在中性化合物中,一个氧原子最多可与碳形成两个单键或一个双键,而一个碳原子最多可与氧形成四个单键或两个双键。
结合基序
电负性和键长
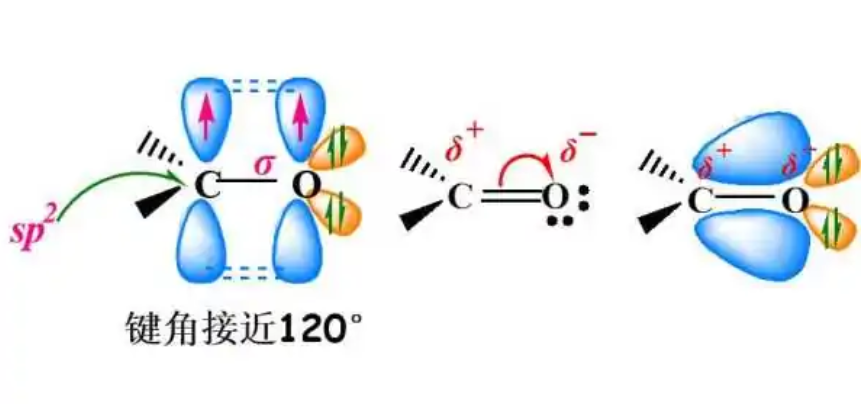
C–O 键强烈极化为氧(C 与 O 的电负性,2.55 与 3.44)。 石蜡基 C-O 键的键长在 143 pm 的范围内——小于 C-N 或 C-C 键。 由于部分双键特征,在羧酸中发现缩短的单键 (136 pm),在环氧化物中发现延长的键 (147 pm)。 C-O 键强度也大于 C-N 或 C-C。 例如,键合强度在甲醇中为 91 千卡 (380 kJ)/mol(在 298 K 时),在甲胺中为 87 千卡 (360 kJ)/mol,在乙烷中为 88 千卡 (370 kJ)/mol。
碳和氧在统称为羰基化合物的官能团中形成末端双键,这些化合物属于酮、酯、羧酸等化合物。 内部 C=O 键存在于带正电的氧鎓离子中。 在呋喃中,氧原子通过其填充的 p 轨道有助于 pi 电子离域,因此呋喃是芳香族的。 在羰基化合物中,C=O 键的键长约为 123 pm。 二氧化碳中的 C=O 键长为 116 pm。
酰卤中的 C=O 键具有部分三键特征,因此非常短:117 pm。 除了具有非常短的强键(112.8 pm)的一氧化碳和酰基离子 R–C≡O+(通常为 110-112 pm)之外,不存在具有正式 C≡O 三键的化合物。 这种三键具有非常高的键能,甚至高于 N-N 三键。 氧也可以是三价的,例如三乙基氧鎓四氟硼酸盐。
化学
碳-氢键形成反应是威廉姆森醚合成、亲核酰基取代和烯烃的亲电加成反应。 Paternò–Büchi 反应涉及羰基化合物。
含氧官能团
碳-氧键存在于这些功能组中