自由能-氧化数图
目录
自由能-氧化数图
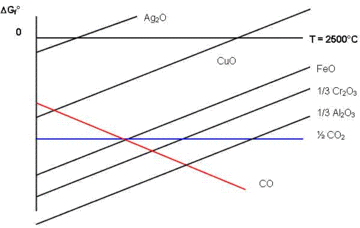
自由能-氧化数图或 Frost-Ebsworth 图是无机化学家在电化学中使用的一种图表,用于说明特定物质的许多不同氧化态的相对稳定性。 该图说明了化学物质的自由能与氧化态。 此效果取决于 pH,因此也必须包括此参数。 自由能由氧化还原半反应决定。 自由能-氧化数图比早期设计的 Latimer 图更容易理解这些还原势,因为“缺乏势的可加性”令人困惑。 自由能ΔG°与图中的还原电势E有关,公式为:ΔG°=-nFE°或nE°=-ΔG°/F,其中n是转移电子数,F是法拉第常数(F = 96,485 J/(V·mol))。
pH 依赖性
pH 依赖性由每个 pH 单位的因子 −0.059m/n 给出,其中 m 与方程中的质子数有关,n 与交换的电子数有关。 电子总是在电化学中交换,但不一定交换质子。 如果反应平衡中没有质子交换,则称该反应与 pH 无关。 这意味着在氧化还原半反应中呈现的电化学势值,其中所讨论的元素改变氧化态,无论执行该过程的 pH 条件如何,都是相同的。
自由能-氧化数图也是比较酸性和碱性溶液的标准电位(斜率)趋势的有用工具。 纯净的中性元素会转变为不同的化合物,具体取决于物种是否处于酸性和碱性 pH 值。 尽管氧化态的值和数量保持不变,但自由能可能变化很大。 自由能-氧化数图允许酸性和碱性图形的叠加,以便简单方便地进行比较。
单位和规模
标准自由能标度以电子伏特为单位测量,nE° = 0 值通常是纯净的中性元素。 自由能-氧化数图通常显示高于和低于 nE° = 0 的自由能值,并以整数缩放。 图表的 y 轴显示自由能。 增加的稳定性(较低的自由能)在图表上较低,因此图表上的元素的自由能越高和越高,它越不稳定和反应性越强。
元素的氧化态显示在自由能-氧化数图的 x 轴上。 氧化态是无单位的,也以正整数和负整数表示。 大多数情况下,自由能-氧化数图以递增顺序显示氧化数,但在某些情况下,它以递减顺序显示。 自由能为零 (nE° = 0) 的中性纯元素的氧化态也为零。 然而,一些同素异形体的能量可能不为零。
因此,直线的斜率表示两个氧化态之间的标准电位。 换句话说,直线的陡度显示了这两种反应物反应并形成最低能量产物的趋势。 有可能具有正斜率或负斜率。 两种物质之间的正斜率表示氧化反应的趋势,而两种物质之间的负斜率表示还原的趋势。 例如,如果 [HMnO4]− 中的锰的氧化态为 +6 且 nE° = 4,而在 MnO2 中的氧化态为 +4 且 nE° = 0,则斜率 Δy/Δx 为 4/2 = 2,产生+2的标准电位。 任何项的稳定性都可以通过该图类似地找到。
渐变
自由能-氧气图中任意两点之间的线的梯度给出了反应的可能性。 位于峰中、高于任一侧两个点的梯度的物质表示在歧化方面不稳定的物质,并且低于连接其两个相邻点的线的梯度的点位于热力学汇中, 并且本质上是稳定的。
坐标轴
自由能-氧化数图的轴显示(水平)所讨论物种的氧化态和(垂直)电子交换数乘以电压 (nE) 或每单位法拉第常数 ΔG 的吉布斯自由能 /F。
歧化与歧化
关于电化学反应,可以使用自由能-氧气数据图可视化两种主要类型的反应。 Comproportionation 是指氧化数不同的两个当量元素结合形成具有中间氧化数的产物。
歧化反应是相反的反应,其中两个当量的氧化数相同的元素反应形成两种不同氧化数的产物。