脂质双分子层
目录
脂质双分子层
表征方法
脂质双层是一种非常难以研究的结构,因为它非常薄且脆弱。尽管有这些限制,在过去的七十年中已经开发了数十种技术来研究其结构和功能。
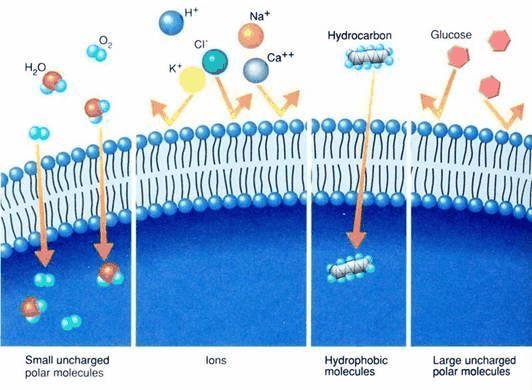
跨双层传输
脂质双层是足够大的结构,具有液体或固体的一些机械性能。面积压缩模量Ka、弯曲模量Kb和边缘能量可以用来描述它们。固体脂质双层也具有剪切模量,但与任何液体一样,流体双层的剪切模量为零。这些机械性能影响膜的功能。Ka和Kb影响蛋白质和小分子插入双层的能力,并且双层机械性能已被证明可以改变机械激活离子通道的功能。双层机械性能也决定了细胞可以承受哪些类型的应力而不会撕裂。尽管脂质双分子层很容易弯曲,但大多数在破裂前不能拉伸超过百分之几。
正如结构和组织部分所讨论的,脂质尾部在水中的疏水吸引力是将脂质双层保持在一起的主要力量。因此,双层的弹性模量主要取决于当脂质分子被拉伸时有多少额外的区域暴露在水中。考虑到对所涉及的力的这种理解,研究表明Ka随渗透压变化很大,但仅随尾长和不饱和度变化很小,这并不奇怪。因为所涉及的力很小,所以很难通过实验确定Ka。大多数技术都需要精密的显微镜和非常灵敏的测量设备。
与衡量拉伸双层需要多少能量的Ka不同,Kb衡量弯曲或弯曲双层需要多少能量。形式上,弯曲模量定义为将膜从其固有曲率变形到某个其他曲率所需的能量。内曲率定义为头组直径与尾组直径之比。对于双尾PC脂质,该比率几乎为1,因此固有曲率几乎为零。如果特定脂质与零固有曲率的偏差太大,它将不会形成双层,而是会形成其他相,例如胶束或倒胶束。将小亲水分子如蔗糖添加到由富含半乳糖脂的类囊体膜制成的混合脂质层状脂质体中会使双层不稳定进入胶束相。通常,Kb不是通过实验测量的,而是通过测量Ka和双层厚度来计算的,因为这三个参数是相关的。
融合
融合是两个脂质双层合并的过程,形成一个连接的结构。如果这种融合完全通过两个双层的两个小叶进行,则会形成一个充满水的桥,并且双层包含的溶液可以混合。或者,如果每个双层中只有一个小叶参与融合过程,则称这些双层是半融合的。融合涉及许多细胞过程,特别是在真核生物中,因为真核细胞被脂质双层膜广泛细分。胞吐作用,通过精子激活使卵子受精,以及将废物运送到溶酶体是依赖于某种形式的融合的众多真核过程中的一小部分。甚至病原体的进入也可以通过融合来控制,因为许多双层包被的病毒具有专用的融合蛋白来进入宿主细胞。
融合过程有四个基本步骤。首先,所涉及的膜必须聚集在一起,彼此接近几纳米。其次,两个双层必须非常紧密地接触(在几埃以内)。为了实现这种紧密接触,两个表面必须至少部分脱水,因为通常存在的结合表面水会导致双层强烈排斥。离子的存在,特别是二价阳离子如镁和钙,强烈影响这一步骤。钙在体内的关键作用之一是调节膜融合。第三,必须在两个双层之间的某一点形成不稳定,局部扭曲它们的结构。这种失真的确切性质尚不清楚。一种理论是高度弯曲的茎必须在两个双层之间形成。该理论的支持者认为,它解释了为什么磷脂酰乙醇胺,一种高度弯曲的脂质,会促进融合。最后,在融合的最后一步,这个点缺陷会增长,两个双层的成分混合并从接触部位扩散出去。
当考虑体内融合时,情况会更加复杂,因为生物融合几乎总是由膜相关蛋白的作用调节。xxx个要研究的蛋白质是病毒融合蛋白,它允许包膜病毒将其遗传物质插入宿主细胞(包膜病毒是那些被脂质双层包围的病毒;其他一些只有蛋白质外壳)。真核细胞也使用融合蛋白,其中研究最多的是SNARE。SNARE蛋白用于引导所有囊泡细胞内贩运。尽管进行了多年的研究,但关于这类蛋白质的功能仍有很多未知之处。事实上,关于SNARE是与早期对接有关还是通过促进半融合参与融合过程的后期,仍然存在激烈的争论。
在分子和细胞生物学研究中,通常需要人工诱导融合。添加聚乙二醇(PEG)会导致融合而没有明显的聚集或生化破坏。该程序现在被广泛使用,例如通过将B细胞与骨髓瘤细胞融合。由这种组合产生的“杂交瘤”表达由所涉及的B细胞确定的所需抗体,但由于黑色素瘤成分而永生化。在称为电融合的过程中,也可以通过电穿孔人工诱导融合。据信,这种现象是由能量活跃的边缘引起的在电穿孔过程中形成,它可以作为局部缺陷点,使两个双层之间的茎生长成核。
模型系统
脂质双层可以在实验室中人工制造,以使研究人员能够进行天然双层无法完成的实验。它们还可以用于合成生物学领域,定义人造细胞的边界。这些合成系统被称为模型脂质双层。有许多不同类型的模型双层,每种都有实验优点和缺点。它们可以用合成或天然脂质制成。最常见的模型系统包括:
商业应用
迄今为止,脂质双层最成功的商业应用是使用脂质体进行药物递送,特别是用于癌症治疗。(注意——术语“脂质体”本质上是“囊泡”的同义词”除了囊泡是结构的总称,而脂质体仅指人工而非天然囊泡)脂质体给药的基本思想是将药物封装在脂质体内部的溶液中,然后注射到患者体内。这些载药脂质体穿过系统,直到它们在目标部位结合并破裂,释放药物。从理论上讲,脂质体应该是一种理想的药物递送系统,因为它们可以分离几乎任何亲水性药物,可以与分子接枝以靶向特定组织,并且由于身体具有降解脂质的生化途径,因此相对无毒。
xxx代药物递送脂质体具有简单的脂质组成,并受到一些限制。由于肾脏清除和吞噬作用,血流中的循环极为有限。改进脂质成分以调节流动性、表面电荷密度和表面水合作用导致囊泡从血清中吸收较少的蛋白质,因此不易被免疫系统识别。该领域最显着的进步是将聚乙二醇(PEG)移植到脂质体表面以产生“隐形”囊泡,该囊泡在没有免疫或肾脏清除的情况下长时间循环。
xxx个隐形脂质体被动地靶向肿瘤组织。因为肿瘤诱导快速和不受控制的血管生成,它们特别“渗漏”,并允许脂质体以比正常组织高得多的速度离开血流。最近已经开展了将抗体或其他分子标记移植到脂质体表面的工作,以期将它们主动结合到特定的细胞或组织类型。这种方法的一些例子已经在临床试验中。
脂质双层的另一个潜在应用是生物传感器领域。由于脂质双层是细胞内部和外部之间的屏障,它也是广泛的信号转导部位。多年来,研究人员一直试图利用这种潜力开发一种基于双层的设备,用于临床诊断或生物恐怖主义检测。该领域的进展缓慢,尽管一些公司已经开发出基于脂质的自动化检测系统,但它们仍然针对研究界。其中包括Biacore(现为GEHealthcareLifeSciences),它提供了一种在结合动力学研究中利用脂质双层的一次性芯片,以及开发了一种自动膜片钳的NanionInc.。系统。其他更奇特的应用也在进行中,例如OxfordNanolabs使用脂质双层膜孔进行DNA测序。迄今为止,该技术尚未被证明具有商业可行性。
如上所述的支持脂质双层(SLB)作为一种测量药物渗透性的筛选技术已经取得了商业上的成功。这种平行的人工膜渗透性测定PAMPA技术可测量发现与Caco-2培养物、胃肠道、血脑屏障和皮肤高度相关的特定配方脂质混合物的渗透性。
脂质双分子层的历史
到20世纪初,科学家们开始相信细胞被一层薄薄的油状屏障所包围,但这种膜的结构性质尚不清楚。1925年的两项实验为填补这一空白奠定了基础。通过测量红细胞溶液的电容,HugoFricke确定细胞膜的厚度为3.3nm。
尽管这个实验的结果是准确的,但弗里克将数据曲解为细胞膜是单分子层。莱顿大学的EvertGorter教授(1881-1954)和F.Grendel从不同的角度解决了这个问题,将红细胞脂质作为单层散布在Langmuir-Blodgett槽上。当他们将单层的面积与细胞的表面积进行比较时,他们发现比例为二比一。后来的分析显示该实验存在几个错误和不正确的假设,但意外的是,这些错误被抵消了,Gorter和Grendel从这个有缺陷的数据中得出了正确的结论——细胞膜是脂质双层。
这一理论在1950年代后期通过使用电子显微镜得到了证实。尽管他没有发表关于脂质双层的xxx个电子显微镜研究,但J.DavidRobertson是xxx个断言两个暗电子密集带是两个并列脂质单层的头部基团和相关蛋白的人。在这项工作中,罗伯逊提出了“单元膜”的概念。这是双层结构xxx次被普遍分配给所有细胞膜以及细胞器膜。
大约在同一时间,模型膜的发展证实了脂质双层是一种稳定的结构,可以独立于蛋白质而存在。通过在孔上“涂上”一种脂质在有机溶剂中的溶液,Mueller和Rudin能够创建一个人造双层,并确定它表现出横向流动性、高电阻和对穿刺的自我修复,所有这些都是属性天然细胞膜。几年后,亚历克·班厄姆(AlecBangham)表明,脂质囊泡形式的双层也可以通过将干燥的脂质样品暴露于水中而简单地形成。这是一个重要的进步,因为它表明脂质双层通过自组装自发形成并且不需要图案化的支撑结构。
1977年,Kunitake和Okahata用单一的有机化合物二十二烷基二甲基溴化铵制备了全合成双层膜。它清楚地表明双层膜是由范德华相互作用组装而成的。