阿伦尼乌斯常数
词条百科 19
简介
在化学动力学中,指前因子或 A 因子是 Arrhenius 方程(如下所示的方程)中的指前常数,它是温度和速率系数之间的经验关系。 它通常由实验确定时指定为 A,而 Z 通常留给碰撞频率。 指数前因子可以被认为是正确定向碰撞频率的度量。 它通常通过测量特定温度下的速率常数 k {displaystyle k} 并将数据拟合到 Arrhenius 方程来通过实验确定。 指前因子通常不是完全恒定的,而是取决于所研究的特定反应和反应发生的温度。
A = k e − E a / R T {displaystyle A={frac {k}{e{-E_{a}/RT}}}}
指前因子 A 的单位与速率常数的单位相同,并且会根据反应的顺序而变化。 对于一级反应,它的单位是 s−1。 因此,它通常被称为频率因子。
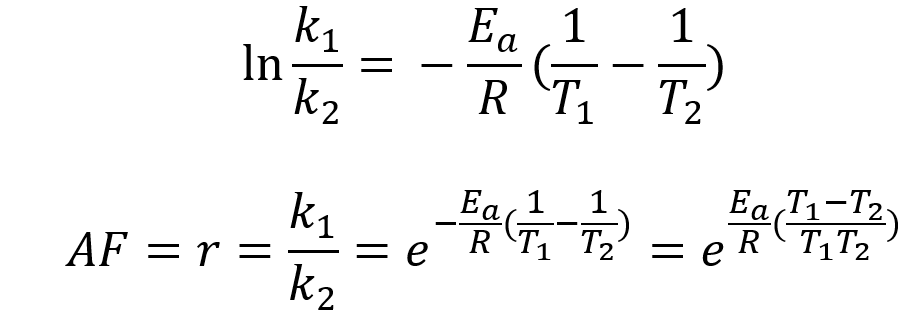
根据碰撞理论,频率因子 A 取决于当所有浓度均为 1 mol/L 时分子碰撞的频率以及分子碰撞时是否正确定向。 某些反应的 A 值可以在 Collision theory#Steric factor 中找到。
根据过渡态理论,A 可以用反应的活化熵来表示。
内容来源于网络,本内容不代表16map.com立场,内容投诉举报请联系16map.com客服。如若转载,请注明出处:https://16map.com/wiki/nmjegi4lmijc