氢过氧化物
目录
氢过氧化物
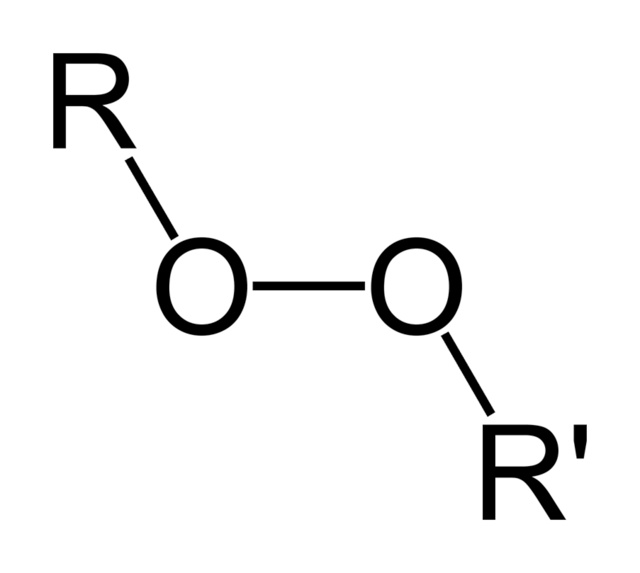
氢过氧化物或过氧醇是含有氢过氧化物官能团(ROOH)的化合物。如果R是有机的,则这些化合物称为有机氢过氧化物。此类化合物是有机过氧化物的子集,其分子式为ROOR。有机氢过氧化物可以有意或无意地在具有不饱和化学键的材料中引发爆炸性聚合。
氢过氧化物的特性
过氧化物中的O-O键长约为1.45Å,R-O-O角(R=H,C)约为110°(类水)。典型地,C-O-O-H二面角约为120°。O-O键相对较弱,键解离能为45-50kcal/mol(190-210kJ/mol),不到C-C、C-H和C-O键强度的一半。氢过氧化物通常比相应的醇更易挥发:
杂项反应
氢过氧化物呈弱酸性。范围由CH3OOH的11.5到Ph3COOH的13.1表示。氢过氧化物可以用氢化铝锂还原为醇,如以下理想化方程式所述:4ROOH+LiAlH4→LiAlO2+2H2O+4ROH该反应是有机过氧化物分析方法的基础。评估过酸和过氧化物含量的另一种方法是用醇盐如乙醇钠进行体积滴定。亚磷酸酯和叔膦也起到还原作用:ROOH+PR3→OPR3+ROH
氢过氧化物的用途
形成
通过自氧化
最重要的(在商业意义上)过氧化物是通过自动氧化产生的,即O2与碳氢化合物的直接反应。自氧化是一种自由基反应,其开始于从相对较弱的CH键中提取H原子。以这种方式制备的重要化合物包括叔丁基过氧化氢、异丙苯过氧化氢和乙苯过氧化氢:RH+O2→ROOH与常见的醚类如乙醚、二异丙醚、四氢呋喃和1,4-二恶烷也观察到自氧化反应。一个示例性产品是过氧化二乙醚。这些化合物在蒸馏时会导致严重的爆炸。为了尽量减少这个问题,商业THF样品通常用丁基化羟基甲苯(BHT)抑制。避免将THF蒸馏至干,因为爆炸性过氧化物浓缩在残留物中。尽管醚氢过氧化物通常是偶然形成的(即自氧化),但它们可以通过将过氧化氢酸催化加成到乙烯基醚中以高产率制备:C2H5OCH=CH2+H2O2→C2H5OCH(OOH)CH3.
从过氧化氢
许多工业过氧化物是使用过氧化氢生产的。与醛和酮的反应根据条件产生一系列化合物。具体反应包括在C=O双键上添加过氧化氢:R2C=O+H2O2→R2C(OH)OOH在某些情况下,这些氢过氧化物转化为环状二过氧化物:[R2C(O2H)]2O2→[R2C]2(O2)2+2H2O将此初始加合物添加到第二当量的羰基中:R2C=O+R2C(OH)OOH→[R2C(OH)]2O2进一步替换醇基:[R2C(OH)]2O2+2H2O2→[R2C(O2H)]2O2+2H2O三苯甲醇与过氧化氢反应生成异常稳定的氢过氧化物Ph3COOH。
天然存在的氢过氧化物
许多氢过氧化物衍生自脂肪酸、类固醇和萜烯。这些物种的生物合成受到酶的广泛影响。