氢键
目录
氢键
氢键(或H键)是共价结合到更具电负性的供体原子或基团(Dn)的氢(H)原子与带有孤对电子的另一个电负性原子之间的主要静电吸引力-氢键受体(Ac)。这种相互作用的系统通常表示为Dn-H···Ac,其中实线表示极性共价键,点划线表示氢键。最常见的供体和受体原子是第二排元素氮(N)、氧(O)和氟(F)。氢键可以是分子间的(发生在不同的分子之间)或分子内的(发生在同一分子的部分之间)。氢键的能量取决于几何形状、环境以及特定供体和受体原子的性质,可以在1到40kcal/mol之间变化。这使得它们比范德华相互作用强一些,比完全共价键或离子键弱。这种类型的键可以发生在无机分子(如水)和有机分子(如DNA和蛋白质)中。氢键负责将纸张和毡制羊毛等材料保持在一起,并导致单独的纸张在变湿并随后干燥后粘在一起。氢键是造成N、O和F化合物的许多异常物理和化学性质的原因。特别是,与其他组相比,分子间氢键是水的高沸点(100°C)的原因-16种氢键较弱的氢化物。分子内氢键部分负责蛋白质和核酸的二级和三级结构。它还在合成和天然聚合物的结构中发挥重要作用。
氢键粘合
氢键的历史
氢键的概念曾经具有挑战性。LinusPauling将1912年首次提到氢键归功于TSMoore和TFWinmill。Moore和Winmill使用氢键来解释三甲基氢氧化铵比四甲基氢氧化铵弱碱这一事实。几年后,即1920年,拉蒂默和罗德布什对氢键在其更为人所知的环境中的描述进行了描述。在那篇论文中,Latimer和Rodebush引用了他们实验室的一位科学家同事MauriceLoyalHuggins的工作,他说,该实验室的Huggins先生在一些尚未发表的工作中使用了两个原子之间的氢核的想法作为关于某些有机化合物的理论。
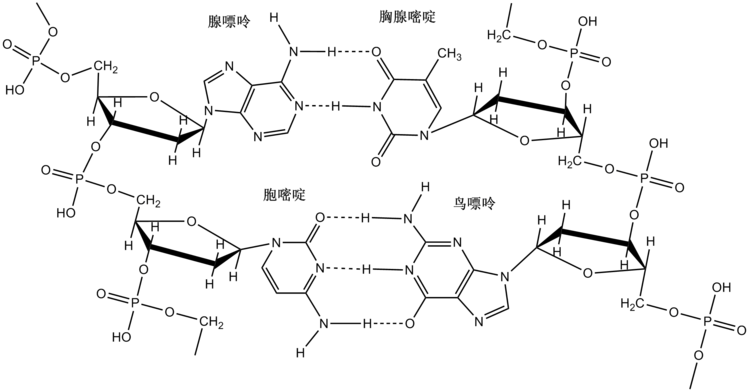
小分子中的氢键
聚合物中的氢键
氢键在确定许多合成和天然蛋白质所采用的三维结构和特性方面起着重要作用。与构成大多数聚合物的CC、CO和CN键相比,氢键要弱得多,可能只有5%。因此,氢键可以通过化学或机械方式断裂,同时保留聚合物骨架的基本结构。这种键强度等级(共价键强于氢键,强于范德华力)是理解许多材料特性的关键。
对称氢键
对称氢键是一种特殊类型的氢键,其中质子恰好位于两个相同原子之间的中间。与这些原子中的每一个的键合强度是相等的。它是三中心四电子键的一个例子。这种键比普通的氢键强得多。有效键阶为0.5,因此其强度与共价键相当。它存在于高压冰中,也存在于许多无水酸如氢氟酸和甲酸的高压固相中。在二氟化物离子[F–H–F]-中也可见。由于严格的空间约束,质子海绵的质子化形式(1,8-双(二甲氨基)萘)及其衍生物也具有对称的氢键([N–H–N]+),尽管在质子化的情况下ProtonSponge,组件弯曲。
双氢键
氢键可以与密切相关的二氢键相比较,二氢键也是涉及氢原子的分子间键合相互作用。这些结构已为人所知一段时间,并通过晶体学很好地表征。然而,对它们与常规氢键、离子键和共价键的关系的理解仍不清楚。通常,氢键的特征是质子受体,它是非金属原子中的孤对电子(最显着的是在氮和硫属元素基团中)。在某些情况下,这些质子受体可能是pi键或金属络合物。然而,在二氢键中,金属氢化物充当质子受体,从而形成氢-氢相互作用。中子衍射表明,这些配合物的分子几何形状类似于氢键。
用光谱手段探测的动力学
水中氢键结构的动力学可以通过OH伸缩振动的红外光谱进行探测。在质子有机离子塑料晶体(POIPCs)中的氢键网络中,POIPCs是一种在熔化前表现出固-固相变的相变材料,变温红外光谱可以揭示氢键的温度依赖性和动力学阴离子和阳离子。固-固相变过程中氢键的突然减弱似乎与离子取向或旋转紊乱的开始有关。
药物应用
氢键是药物设计的关键。根据Lipinski的五法则,大多数口服活xxx物往往具有不超过五个氢键供体和少于十个氢键受体。这些相互作用存在于氮-氢和氧-氢中心之间。然而,多达一半的新药不遵守这些规则。