铁钼辅因子
目录
铁钼辅因子
铁锤辅因子(FeMo辅助因子)是固氮酶的主要辅助因子。 固氮酶是通过称为固氮的过程催化大气中的氮分子 N2 转化为氨 (NH3) 的酶。 含有铁和钼的辅因子称为铁锻辅因子。 它的化学计量是Fe7MoS9C。
FeMo 辅助因子是一个组成为 Fe7MoS9C 的簇。 Fe 是元素铁(铁)的化学符号,Mo 是钼的符号。 这个大团簇可以被视为由一个 Fe4S3(硫化铁(III))团簇和一个 MoFe3S3 团簇组成的两个亚基。 这两个簇由三个硫化物配体连接。 独特的铁 (Fe) 通过半胱氨酸固定在蛋白质上。 它还与三个硫化物结合,形成四面体分子几何结构。 簇中另外六个 Fe 中心分别与三个硫化物键合。 这六个内部 Fe 中心定义了围绕中心碳化物中心的三角棱柱排列。 钼与三个硫化物相连,并通过组氨酸残基的咪唑基团固定在蛋白质上。 还与 Mo 结合的是二齿高柠檬酸辅助因子,导致八面体几何形状。 MoFe 蛋白质的晶体学分析初步提出了铁锻副因子的几何结构,并通过扩展 X 射线吸收精细结构 (EXAFS) 研究证实了这一点。 Fe-S、Fe-Fe 和 Fe-Mo 距离分别确定为 2.32、2.64 和 2.73 Å。
铁锻辅因子的电子特性
根据电子顺磁共振波谱分析,FeMo辅助因子的静息态自旋态为S=3/2。 单电子还原后,辅助因子变为 EPR 沉默。 了解电子在蛋白质加合物中转移的过程显示了更精确的 FeMo 辅因子动力学模型。 密度泛函理论计算表明形式氧化态为 MoIV-2FeII-5FeIII-C4−-H+,但真正的氧化态尚未通过实验证实。
铁锤副因子的生物合成是一个复杂的过程,需要多种 Nif 基因产物,特别是 nifS、nifQ、nifB、nifE、nifN、nifV、nifH、nifD 和 nifK(表达为蛋白质 NifS、NifU 等) . 铁锤副因子组装被认为是由 NifS 和 NifU 引发的,它们将 Fe 和硫化物移动成小的 Fe-S 碎片。 这些片段被转移到 NifB 支架并排列成 Fe7MoS9C 簇,然后转移到 NifEN 蛋白(由 nifE 和 nifN 编码)并在传递到 MoFe 蛋白之前重新排列。 其他几个因素参与生物合成。 例如,NifV 是向铁钓辅因子提供高柠檬酸的高柠檬酸合酶。 NifV 是一种蛋白质因子,被认为参与了 Mo 的储存和/或动员。Fe 蛋白质是 MoFe 蛋白质的电子供体 6。 这些生物合成因子已通过生化、光谱和结构分析证实的确切功能和序列得到阐明和表征。
隔离
通过将固氮酶离心沉降到 MoFe 蛋白和 Fe 蛋白中,从固氮酶中分离出 FeMo 辅助因子。 通过用酸处理 MoFe 蛋白来提取 FeMo 辅助因子。 xxx次提取使用 N,N-二甲基甲酰胺进行,第二次使用 N-甲基甲酰胺和 Na2HPO4 的混合物进行提取,然后通过离心进行最终沉淀。
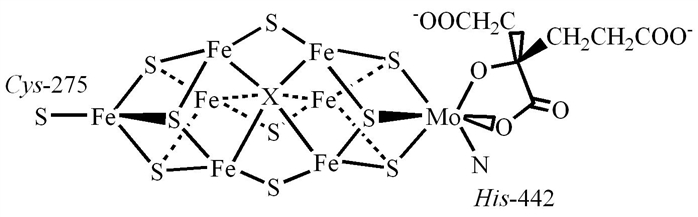
辅助因子中核心原子的身份
在 M 簇合成中起直接作用的三种蛋白质是 NifH、NifEN 和 NifB。 NifB 蛋白负责组装辅助因子的 Fe-S 核心; 一个涉及将两个 [4Fe-4S] 簇拼接在一起的过程。 NifB 属于 SAM(S-腺苷-L-甲硫氨酸)酶超家族。 在 FeMo 辅助因子的生物合成过程中,NifB 及其 SAM 辅助因子直接参与在 Fe-S 复合物中心插入碳原子。 等量的 SAM 提供甲基,成为 M 簇的间隙碳化物。 SAM 的甲基通过 5′-脱氧腺苷自由基 (5′-dA·) 去除 H 的自由基而动员起来。 据推测,形成了一个短暂的 –CH2· 自由基,随后结合到金属簇中形成 Fe6-碳化物物种。 插入固氮酶后,间隙碳仍与 FeMo 辅因子结合,中心碳原子已通过 13C 标记和脉冲 EPR 光谱检测得到证实。 除了 EPR 光谱外,还使用 X 射线衍射法验证了 FeMo 辅助因子中间有一个中心原子,X 射线发射光谱研究表明由于 2p → 1s 碳-铁跃迁,中心原子是碳 . X 射线晶体学的使用表明,虽然 FeMo 辅助因子不是催化形式,但碳保持结构刚性,这有助于描述固氮酶的反应性。