压缩因子
目录
压缩因子
系统属性注意:共轭变量以斜体显示
材料特性
- 属性数据库
可压缩性 β = − {displaystyle beta =-}
热膨胀 α = {displaystyle alpha =}
方程式
- 卡诺定理
- 克劳修斯定理
- 基本关系
- 理想气体定律
- 麦克斯韦关系
- Onsager 互惠关系
- 布里奇曼方程
- 热力学方程表
潜力
- 自由能
- 自由熵
- 内能 U ( S , V ) {displaystyle U(S,V)}
- 焓 H ( S , p ) = U + p V {displaystyle H(S,p)=U+pV}
- 亥姆霍兹自由能 A ( T , V ) = U − T S {displaystyle A(T,V)=U-TS}
- 吉布斯自由能 G ( T , p ) = H − T S {displaystyle G(T,p)=H-TS}
- 历史
- 文化
科学家们
- 伯努利
- 玻尔兹曼
- 布里奇曼
- 卡拉西奥多里
- 卡诺
- 克拉佩龙
- 克劳修斯
- 德唐德
- 迪昂
- 吉布斯
- 冯·亥姆霍兹
- 焦耳
- 刘易斯
- 马修
- 麦克斯韦
- 冯迈耶
- 能斯特
- 昂萨格
- 普朗克
- 兰金
- 史密顿
- 斯塔尔
- 泰特
- 汤普森
- 汤姆逊
- 范德瓦尔斯
- 沃特斯顿
其他
- 成核
- 自组装
- 自组织
- 秩序与混乱
- 类别
- v
- t
- e
在热力学中,压缩系数 (Z),也称为压缩系数或气体偏差系数,描述了实际气体与理想气体行为的偏差。 简单定义为在相同温度和压力下,气体的摩尔体积与理想气体的摩尔体积之比。 它是一种有用的热力学性质,可用于修改理想气体定律以解释实际气体行为。 一般来说,气体越接近相变、温度越低或压力越大,与理想行为的偏差就变得越明显。 压缩因子值通常通过状态方程 (EOS) 的计算获得,例如以化合物特定经验常数作为输入的维里方程。 对于两种或多种纯气体(例如空气或天然气)的混合物的气体,必须先知道气体成分,然后才能计算可压缩性。 或者,可以从广义压缩率图表中读取特定气体的压缩系数,该图表将 Z {displaystyle Z} 绘制为恒定温度下压力的函数。
压缩系数不应与材料的可压缩性(也称为可压缩系数或等温可压缩性)混淆,后者是衡量流体或固体响应压力变化的相对体积变化的量度。
定义和物理意义
压缩因子在热力学和工程学中通常定义为:
其中 p 是压力,ρ {displaystyle rho } 是气体的密度,R specific = R M {textstyle R_{text{specific}}={frac {R}{M} }} 是特定气体常数,M {displaystyle M} 是摩尔质量,T {displaystyle T} 是xxx温度(开尔文或朗肯标度)。
在统计力学中的描述是:
其中 p 是压力,n 是气体的摩尔数,T {displaystyle T} 是xxx温度,R {displaystyle R} 是气体常数。
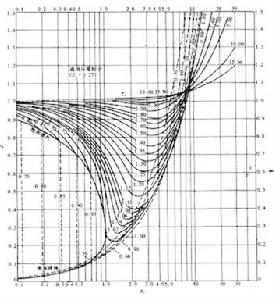
对于理想气体,根据定义,压缩系数为 Z = 1 {displaystyle Z=1}。 在许多现实世界的应用中,对精度的要求要求考虑与理想气体行为(即真实气体行为)的偏差。 Z {displaystyle Z} 的值通常随压力增加而随温度降低。 在高压下,分子碰撞的频率更高。 这使得分子间的排斥力产生明显的影响, 当压力较低时,分子可以自由移动。 在这种情况下,吸引力占主导地位 . 气体越接近其临界点或沸点, 就越偏离理想情况。