饥饿素
饥饿素(/ˈɡrɛlɪn/;或 lenomorelin,INN)是一种由胃肠道,尤其是胃的肠内分泌细胞产生的激素,通常被称为饥饿激素,因为它会增加进食的动力。 饥饿时饭前血液中生长素释放肽的水平最高,饭后恢复到较低水平。 饥饿素可以通过增加胃动力和刺激胃酸分泌来帮助准备食物摄入。
饥饿素激活垂体前叶腺和下丘脑弓状核中的细胞,包括引发食欲的神经肽 Y 神经元。 饥饿素刺激具有特定受体的大脑结构——生长激素促分泌素受体 1A (GHSR-1A)。 饥饿素还参与奖励认知、学习和记忆、睡眠-觉醒周期、味觉、奖励行为和葡萄糖代谢的调节。
历史与名称
饥饿素是在 1999 年确定生长激素释放肽受体(称为生长激素促分泌素 1A 型受体或 GHS-R)后发现的。激素名称是基于其作为生长激素释放肽的作用,参考原印度- 欧洲词根 gʰre-,意思是成长。
基因、转录产物和结构
GHRL 基因产生具有四个外显子的 mRNA。 出现了五种产品:xxx种是 117 个氨基酸的前促生长素释放肽。 与促胃动素同源; 两者都是促胃动素家族的成员。 它被切割产生生长素释放肽前体,后者被切割产生未酰化的 28-氨基酸生长素释放肽和酰化 C-生长素释放肽。 据推测,Obestatin 是从 C-ghrelin 上切割下来的。
饥饿素仅在辛酸(辛酸)通过生长素释放肽 O-酰基转移酶 (GOAT) 翻译后连接到 3 位丝氨酸时才变得活跃,形成蛋白脂质。 它位于胃和胰腺中生长素释放肽细胞的细胞膜上。 非辛酰化形式是去酰基生长素释放肽。 它不激活 GHS-R 受体,但具有其他作用:强心、抗胃饥饿素、刺激食欲和抑制肝葡萄糖输出。 还观察到辛酰基以外的侧链:这些侧链也可以触发生长素释放肽受体。 特别是,已发现癸酰生长素释放肽构成小鼠循环生长素释放肽的重要部分,但截至 2011 年,其在人类中的存在尚未确定。
饥饿素细胞
功能与作用机制
饥饿素是调节能量稳态复杂过程的参与者,它通过调节饥饿信号来调节能量输入和能量输出——通过调节用于 ATP 生产、脂肪储存、糖原储存和短期热量的能量比例 失利。 这些过程的最终结果反映在体重上,并根据代谢信号和需要进行持续监测和调整。 在任何给定的时刻,它可能处于平衡或不平衡状态。
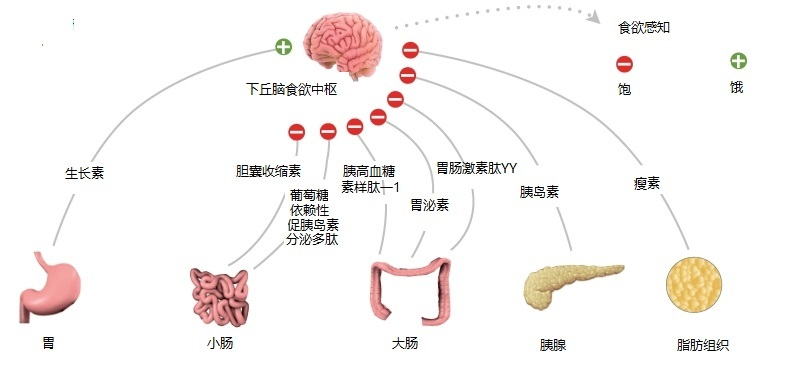
胃脑通讯是能量稳态的重要组成部分,可能有几种通讯途径,包括胃细胞内 mTOR/S6K1 途径介导生长素释放肽、nesfatin 和内源性大麻素胃系统之间的相互作用,以及传入和传出迷走神经信号。
饥饿素和合成生长素释放肽模拟物(生长激素促分泌素)通过触发弓状核中的受体(包括神经肽 Y (NPY) 和刺豚鼠相关蛋白 (AgRP) 神经元)来增加体重和脂肪量。 这些神经元的饥饿素反应对瘦素和胰岛素都敏感。 饥饿素降低了胃迷走神经传入神经的敏感性,因此它们对胃扩张不太敏感。
除了其在能量稳态中的功能外,生长素释放肽还激活胆碱能-多巴胺能奖励链接,输入到腹侧被盖区和中间层。